Approche théranostique
des carcinoses péritonéales ovariennes
Notre équipe développe plusieurs axes de recherche autour de l’approche théranostique de la carcinose péritonéale d’origine ovarienne.
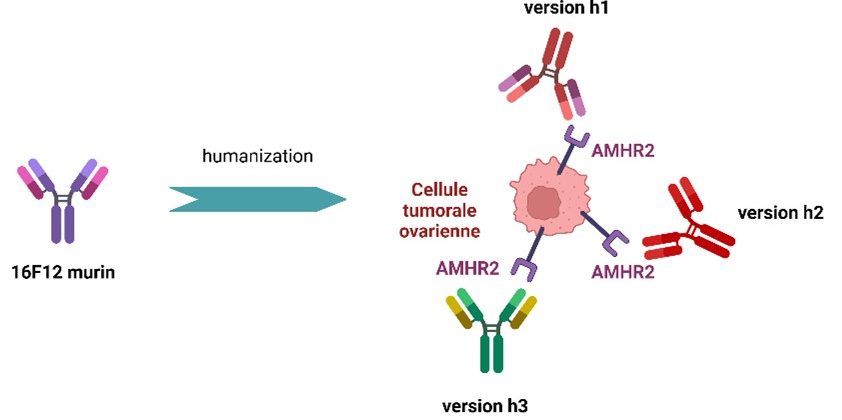
Des anticorps monoclonaux ciblant MISRII
Notre équipe a développé plusieurs anticorps monoclonaux humanisés ciblant spécifiquement le récepteur de type II (AMHRII) de l’hormone anti-müllérienne (AMH). Notre objectif est d’évaluer leurs propriétés théranostiques après couplage à un radionucléide à visée diagnostique ou thérapeutique. Ils sont actuellement en cours d’évaluation dans des modèles précliniques Mais notre objectif final est de les transférer en clinique pour les évaluer chez les patientes.
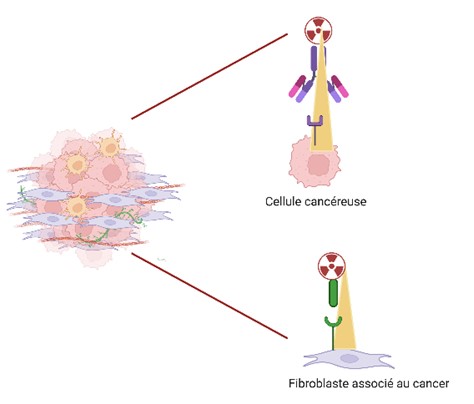
Des nanobodies ciblant les CAFs
Dans le cadre d’un partenariat avec une société pharmaceutique nous evaluons aussi les propriétes theranostique d’Anticorps à domaine unique dirigé (nanobodies) contre la protéine FAP exprimée par les fibroblastes associés au cancer (CAFs). Nous espérons pouvoir associer une approche de RIV anti- anti-AMHRII dirigé contre les cellules tumorales à une approche anti-FAP dirigées contre les CAFs.
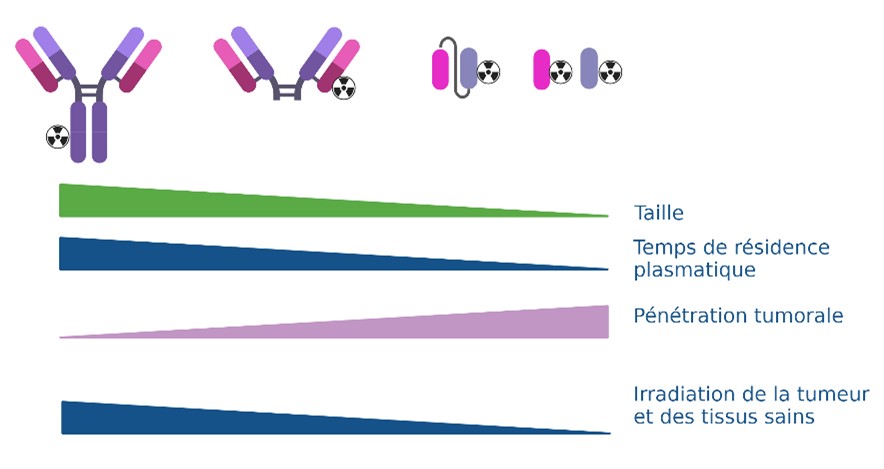
Influence du format de l’anticorps
Nos travaux visent à déterminer quel est le meilleur format d’Acm anti-AMHRII pour une approche théranostique. Pour cela nous modifions les anticorps afin de faciliter leur pénétration dans la tumeur et/ou, dans le noyau cellulaire et accroître leur temps de résidence dans celle-ci tout en limitant l’exposition des tissus sains.
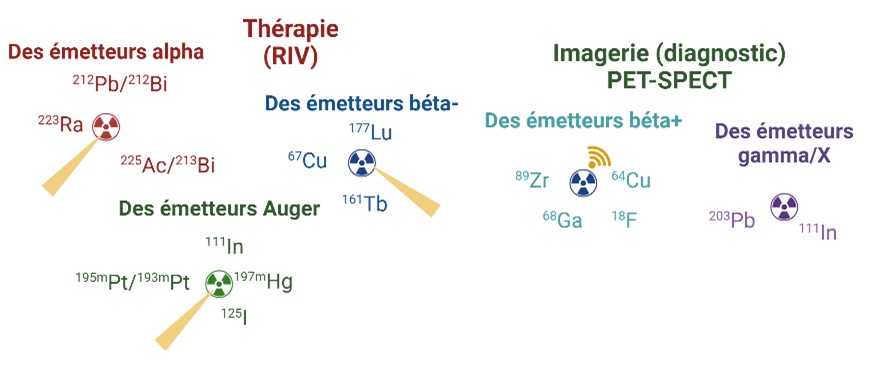
Évaluer différents radionucléides thérapeutiques
Après avoir exploité le paramètre vecteur, nous élargissons également notre intérêt à un vaste panel d’isotopes radioactifs, qu’ils soient naturels ou produits dans des réacteurs nucléaires ou via des cyclotrons. Les particules émises par les atomes radioactifs n’ont pas toute la même nature, la même portée (quelques nm à plusieurs mm), elles n’ont pas non plus la toxicité pour les cellules irradiées.
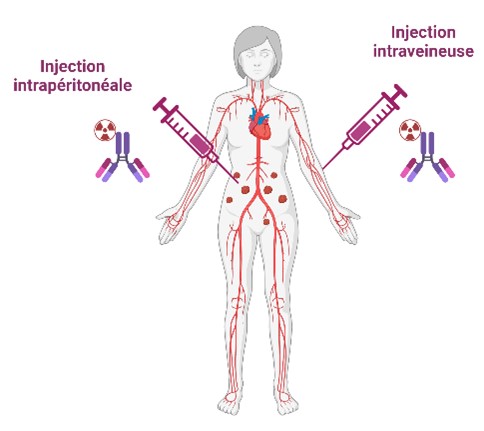
Exploiter différentes modalités d’administration
Si l’administration intraveineuse est généralement utilisée, l’administration intrapéritonéale au bloc opératoire après résection chirurgicale peut être envisagée. Elle devrait être suivie d’administration IV dans les semaines suivantes.
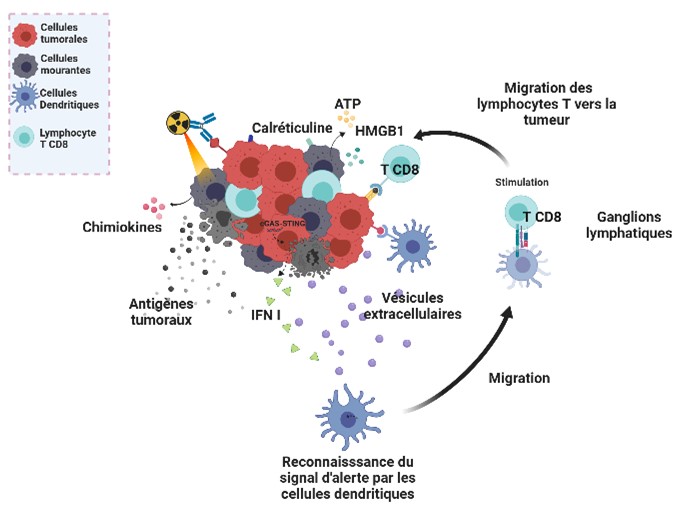
Étudier comment les cellules irradiées peuvent stimuler le système immunitaire du patient
Le système immunitaire peut dans certaines conditions lutter contre la tumeur mais il doit pour cela être stimulé. La RIV peut jouer ce rôle. En détruisant les cellules tumorales, la RIV expose au système immunitaire des molécules qui constituent un signal d’alerte pour l’organisme (HMGB1, ATP, Calréticuline etc.) qui s’associent à la libération de petites molécules caractéristiques de la tumeur (« carte d’identité »).
Ces molécules conduisent à l’activation des cellules dendritiques qui va les communiquer aux lymphocytes T qui en retour vont pouvoir reconnaître la tumeur et participer à sa destruction.
Dans ce contexte, les lésions de l’ADN produites dans les cellules irradiées conduisent aussi à la libération de fragments d’ADN par les cellules irradiées qui peuvent être transportés à distance de la cellule par l’intermédiaire de vésicules dites extracellulaires.
Ces vésicules peuvent ainsi interagir soit avec des cellules immunitaires et participer au caractère immuno-stimulateur de la RIV ou dans certains cas avec les cellules tumorales et les détruire.
Nous devons toutefois veiller à ce que l’irradiation ne soit pas trop fort et n’endommage le système immunitaire. C’est le but de la dosimétrie.

Rien n’est possible sans la dosimétrie
La dosimétrie permet de déterminer la dose de radiations délivrée aux tissus sains et à la tumeur. La dose d’irradiation est le premier paramètre expliquant l’efficacité de la RIV ou sa toxicité sur les tissus sains. Elle fait appel à des mesures par imagerie chez le patient après administration du radiopharmaceutique et à des calculs utilisant des outils de simulation.
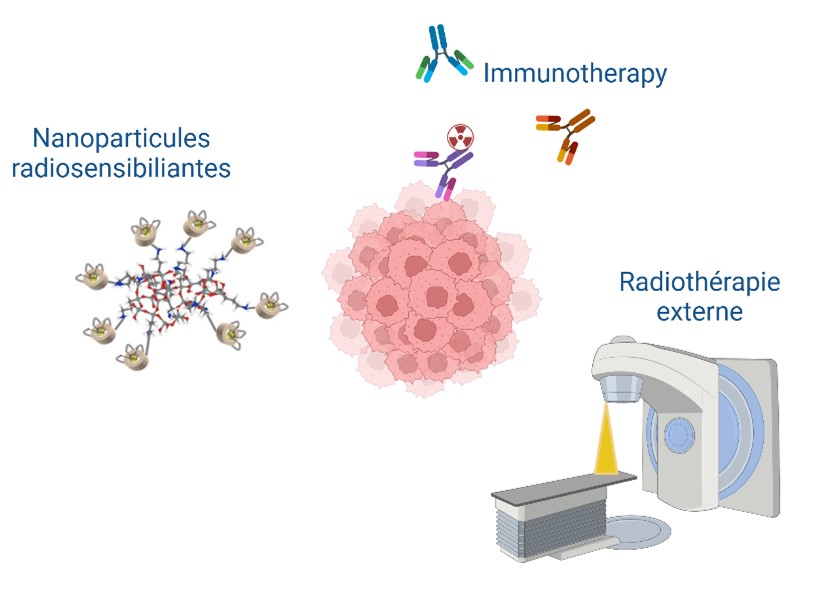
Trouver les meilleures associations thérapeutiques
Comme dans bien des situations il apparaît que pour tirer profit de la RIV celle-ci doive être associée de façon optimale à d’autres approches thérapeutiques. Notre équipe se focalise sur l’association avec des systèmes de nanoparticules qui accroissent l’effet des radiations, d’autres qui participent à la stimulation du système immunitaire. Enfin dans certains cas nous envisageons d’associer RTE et RIV.
Une recherche qui intègre le patient
Grâce à l’implication des patients, il nous est possible de vérifier sur des prélèvements d’échantillons de patients (biopsies tumorale ou liquide i.e. des échantillons de sang) la solidité des hypothèses et données obtenues dans des modèles précliniques. Il s‘agit d’un caractère très translationnel de notre recherche, c’est-à-dire du laboratoire au patient.
En retour nous pouvons grâce aux données obtenues corriger nos modèles d’études précliniques afin qu’ils soient le plus prédictif de l’efficacité thérapeutique ou de la toxicité ceci dans le but d’avoir le traitement le plus efficace et présentant le moins d’effets secondaires.
Découvrez plus d’informations sur ce sujet en visitant :
https://immunoriv.fr/